
一、 设备名称:紫外可见分光光度计
规格型号:岛津UV2600
二、各项具体技术参数:
光谱带宽:4nm;
光度准确度:±0.004Abs(0-0.5Abs)±0.005(0.5-1.0Abs);±0.3%T;
光度重复性:±0.001Abs(0-0.5Abs);±0.002(0.5-1.0Abs)±0.2%T;
波长范围:200-1400nm;
波长准确度:±0.8nm;
波长重复性:0.3nm;
波长显示:0.1nm;
杂散光:≤0.05%T@220nm和340nm处;
光度范围:0~200%T,-0.3~3.0A,0-9999C(0-9999F);
光学系统:单光束(双光束比例检测可选),1200条/毫米衍射全息光栅;
三、工作原理:
紫外-可见分光光度法是利用某些物质分子能够吸收200~~800nm光谱区的辐射来进行分析测定的方法。这种分子吸收光谱源于价电子或分子轨道上电子的电子能级间跃迁,广泛用于无机和有机物质的定量测定,辅助定性分析(如配合IR)。
1.分子吸收光谱的产生
在分子中,除了电子相对于原子核的运动外,还有核间相对位移引起的振动和转动。这三种运动能量都是量子化的,并对应有一定能级。当用频率为w的电磁波照射分子,而该分子的较高能级与较低能级之差△E恰好等于该电磁波的能量hw时,即有:

用一连续电磁光照射时,在微观上出现分子由较低能级跃迁到较高的能级,在宏观上则透射光的强度变小。
电磁波照射分子,将照射前后光强度的变化转变为电信号,并记录下来,然后以波长(A)为横坐标,以电信号(吸光度A)为纵坐标,就可以得到—张光强度变化对波长的关系曲线图,即紫外吸收光谱图,从曲线图中可以看出不同波长对应的吸光度,找出吸收样品对应的最大吸收波长。待测样品浓度与吸光度A满足Lambert-Beer定律,其数学表达式如式

式中,I0为入射光强度; I为透射光强度;A称为吸光度(Absorbance)、吸收度或光密度(OD,Optical Density) ; a称为吸收系数(Absorptivity),是化合物分子的特性,它与浓度(c)和光透过介质的厚度(b)无关;当c为物质的量浓度,b以厘米为单位时,a即以ε来表示,称为摩尔吸光系数(molar absorptivity)。
按Lambert-Beer定律可进行定量测定。测量时盛溶液的吸收池厚度为b,若浓度c已知,测得吸光度A即可计算出e值,后者为化合物的物理常数。若已知e值,则由测得的吸光度A可计算溶液的浓度。
2.价电子跃迁的类型以及吸收带
A、有机物的价电子跃迁
在有机化合物分子中有形成单键的σ电子、形成不饱和键的π电子以及未成键的孤对n电子。当分子吸收紫外或者可见辐射后,这些外层电子就会从基态(成键轨道)向激发态(反键轨道)跃迁,主要的跃迁方式有四种,所需能量大小顺序为: σ→σ* >n→σ*>π→π*>n→π*。
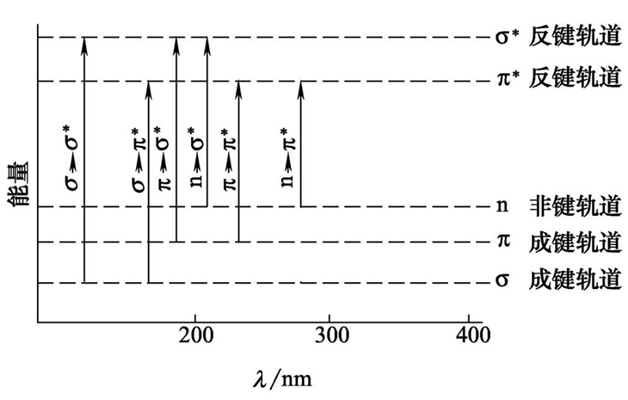
图1 各种电子跃迁相应的吸收峰和能量示意图
σ→σ*跃迁:吸收能量较高,一般发生在真空紫外区。饱和怪中的C-C属于这种跃迁类型。如乙烷C-C键σ→σ*跃迁,λmax为135nm。(注:由于一般紫外可见分光光度计只能提供190~850nm范围的单色光,因此无法检测σ→σ*跃迁)
n→σ*跃迁:含有O、N、S等杂原子的基团,如-NH2、-OH-、-SH等可能产生n→σ*跃迁,摩尔吸光系数较小。
π→π*跃迁:有π电子的基团,如C=C,C=C,C=O等,会发生π→π*跃迁,一般位于近紫外区,在200 nm左右,εmax≥104 L mol-1 cm-1,为强吸收带。
K带:共辄体系的π→π*跃迁又叫K带,与共辄体系的数目、位置和取代基的类型有关。
B带:芳香族化合物的π→π*跃迁而产生的精细结构吸收带叫做B带。
E带:E带是苯环上三个双键共轮体系中的π电子向π*反键轨道跃迁的结果,可分为E1和E2带(K带)。
n→π*跃迁:含有杂原子的不饱和基团:如C=O,C=S,-N=N-等基团会发生n→π*。发生这种跃迁能量较小,吸收发生在近紫外或者可见光区。特点是强度弱,摩尔吸光系数小,产生的吸收带也叫R带。
B.无机物中的电子跃迁
无机化合物的紫外可见吸收主要是由电荷转移跃迁和配位场跃迁产生。
电荷转移吸收光谱出现的波长位置,取决于电子给体和电子受体相应电子轨道的能量差。一般,中心离子的氧化能力越强,或配体的还原能力越强(相反,若中心离子的还原能力越强,或配体的氧化能力越强),则发生电荷转移跃迁时所需能量越小,吸收光谱波长红移。
配位场跃迁:元素周期表3中第4和第5周期过渡元素分别含有3d和4d轨道,铜系和铜系元素分别有4f和5f车道。这些轨道能量通常是简并(相等)的,但是在络合物中,由于配体的影响分裂成了几组能量不等的轨道。若轨道是未充满的,当吸收光后,电子会发生跃迁,分别称为d-d跃迁和f-f跃迁。
四、应用领域
1、材料科学与工程:
紫外可见分光光度计分析就是根据物质的吸收光谱研究物质的成分、结构和物质间相互作用的有效手段。物质的吸收光谱本质上就是物质中的分子和原子吸收了入射光中的某些特定波长的光能量,相应地发生了分子振动能级跃迁和电子能级跃迁的结果。由于各种物质具有各自不同的分子、原子和不同的分子空间结构,其吸收光能量的情况也就不会相同,因此,每种物质就有其特有的、固定的吸收光谱曲线,可根据吸收光谱上的某些特征波长处的吸光度的高低判别或测定该物质的含量,这就是分光光度定性和定量分析的基础。紫外可见分光光度法的定量分析基础是朗伯-比尔(Lambert-Beer)定律。朗伯定律是说明光的吸收与吸收层厚度成正比,比耳定律说明光的吸收与溶液浓度成正比;如果同时考虑吸收层厚度和溶液浓度对光吸收率的影响,即朗伯-比耳定律。
2、分光光度计的用途之一是鉴定物质。
用来测量待测物质对可见光的吸光度并进行定量分析的仪器,称为可见分光光度计;紫外可见分光光度计用来测量待测物质对可见光或紫外光(200~760nm)的吸光度并进行定量分析的仪器。可以测定核酸和蛋白的浓度,也可以测定细菌细胞密度。
3、分光光度计的用途之二待测物质是标准物及标准图谱对照进行分析。
4、分光光度计的用途之三是比较最大吸收波长吸收系数的一致性。
5、分光光度计的用途之四是物质的纯度检验。
5、分光光度计的用途之五是推测化合物的分子结构及构成。
7、分光光度计的用途之六是判定络合物的组成及稳定常数的测定。
五、可开展实验项目
1、物质浓度测定
2、吸光度测定
3、测定半导体禁带宽度
4、测定物质纯度
5、测定反应动力学过程
六、可培训技能
1、了解紫外-可见分光光度计的结构、性能及其使用方法;
2、掌握吸收曲线的绘制和标准曲线的绘制
3、根据吸收曲线选择最佳测量波长、根据标准曲线进行定量计算。
七、具体操作规程
测试说明:
普通测试波长250~800 nm。根据测试要求可以调试范围至200~1400 nm测试样品状态:固体粉末,薄膜,液体。
准备样品:
固体粉末:60 mg(样品)+1.8 g (BaSO:)研磨混合均匀(:或200 mg样品+1.8g BaSO分别储存)。
薄膜:无需特别处理。
液体:提前准备溶剂作为参比样,将液体稀释到澄清:如果是悬浮液。稀释到澄
清以后,再超声10min。
测试步骤
一、固体粉末及薄膜测试
1、开机前先将两片标样 BaSO:放在反射测试位置(3、4)。
2、开启 UV-2600
3、打开桌面软件, 连接仪器及软件
连接仪器及软件
4、设置参数:
A、点击
B、设置测试范围:800-200 nm(波长扫描从高到底)。测试速率:低速c、测试模式:反射率(圆体一般测试反射率)
D、检测器模式:外置双检测器
5、测试基线,点击-基线
6、完成基线测试,点击自动调零
7、将测试样品放在3号位置。关上仪器窗口
8、点击“开始"。开始测量
9、储存数据:
A、“文件”-“另存为”-“REF XXX.spc”光谱文件格式B、“文件"-“另存为”-“REF XXX.txt”数据打印表格式
C、文件转化:点击“ ”-计算类型选择转化-转化模式
”-计算类型选择转化-转化模式 -点击计算
-点击计算
E、“文件”-“另存为”- “REF-ABS XXX.spe”光谱文件格式
F、“文件”-“另存为”-“REF-ABS XXX.txt”数据打印表格式
10、完成测试,关闭仪器及电脑,收好测试样品及辅助工具
二、液体测试
1、关闭电源,更换基座:将积分球换为液体直接测量基座
2、开机前先将两份溶剂最在石英比色皿中,放在吸收测试位置G1、2)3、开启 UV-2600
3、开启UV-2600
4、打开桌面软件, 连接仪器及软件
连接仪器及软件
5、设置参数:
A、点击
B、设置测试范围:800-200 nm(波长扫描从高到底),测试速率:中速
C、测试模式:吸收率
D、检测器模式:直接6、测试基线,点击·基线
7、完成基线测试。点击自动调零
8、将测试样品故在1号位置,关上仪器窗口
9、点击“开始”,开始测量
10、储存数据:
A、“文件”-“另存为”-“ABS XxX.spc”光谱文件格式
B、“文件”-“另存为”-“ABS XXX.txt”数据打印表格式
11、完成测试,关闭仪器及电脑,收好测试样品及辅助工具
八、安全注意事项
(1)使用仪器时要注意用电安全;
(2)严格按照开关机顺序进行开关机操作;
(3)定期更换光源;
(4)换取样品,使用橡胶手套操作,切不可用手直接接触比色皿透光面;
(5)在拷贝数据时,建议使用专用U盘来拷贝数据;
(6)放置样品时,样品一定要卡到位,否则载物台此时将会报警,严重时载物台会卡舱门;
(7)在拷贝数据时,建议使用光盘来拷贝数据,严禁使用U盘,移动硬盘等;
(8)更换样品槽时,一定要注意装置卡槽是否到位。
